Patologie: Occhio secco
Malattia dell’occhio secco – Dry eye disease
La Malattia dell’occhio secco (Dry Eye Disease-DED) è una delle più frequenti patologie che l’oftalmologo incontra nella pratica clinica. Nonostante l’elevata prevalenza di questo tipo di problema, fino a poco tempo fa, i meccanismi fisiopatologici che ne stanno alla base erano poco conosciuti. Fortunatamente, negli ultimi vent’anni, sono stati fatti notevoli progressi nella comprensione della patogenesi dell’occhio secco. Queste evidenze scientifiche hanno sottolineato l’importanza di aggiornare classificazioni, approccio diagnostico e terapie mirate per la gestione e il trattamento dell’occhio secco.
L’attuale definizione di DED è stata stabilita nel corso dell’International Dry Eye Workshop (DEWS) della Tear Film and Ocular Surface Society, che ha presentato l’ultimo aggiornamento nel 2017 (DEWS II): “L’occhio secco è una malattia multifattoriale della superficie oculare caratterizzata da una perdita di omeostasi del film lacrimale e accompagnata da sintomi oculari, in cui l’instabilità e l’iperosmolarità del film lacrimale, l’infiammazione, le lesioni della superficie oculare e le anomalie neurosensoriali svolgono ruoli eziologici”. Ciascun termine riveste un ruolo fondamentale nella comprensione della patologia. L’etiopatogenesi è, infatti, complessa e dipende dall’alterazione dell’omeostasi del microambiente della superficie oculare legata al circolo vizioso derivante dai meccanismi di instabilità del film lacrimale, iperosmolarità e conseguente infiammazione con rilascio di citochine proinfiammatorie.
Di recentissima introduzione è il concetto che anomalie neurosensoriali possano contribuire alla patogenesi della DED; questo è legato presumibilmente alla attivazione di nocicettori corneali che può dipendere non solo da stimoli meccanici ma anche da stimoli chimici con conseguente neuroinfiammazione, alterazione del film lacrimale e iperosmolarità secondaria. Seppure non siano del tutto noti i meccanismi che portano al danno nocicettivo, è verosimile che questo sia responsabile della discrepanza tra segni obiettivi e sintomi riferiti dal paziente che talvolta si verifica. Non da ultimo, secondo la recente letteratura, l’instabilità del film lacrimale esporrebbe la superficie a stimoli termici, che sembrano anch’essi partecipi nel processo di attivazione dei recettori nocicettivi. Per questo motivo anche solo un Tear film Break Up Time (T-BUT) ridotto può risultare in presenza di sintomi severi conseguenti alla stimolazione dei nocicettori per il freddo che si verifica per l’aumento dell’evaporazione e al relativo abbassamento della temperatura locale.
È bene tenere a mente che oltre a fattori puramente oculari anche alcune condizioni sistemiche possono influenzare la presentazione dell’occhio secco. È infatti noto che, per ogni patologia è possibile fare una differenza di genere; nel caso della malattia dell’occhio secco il sesso femminile è stato indicato dalla letteratura come più predisposto, con inasprimento dei sintomi dall’epoca della menopausa fino a tutto il periodo post menopausale. Altra caratteristica legata al sesso è la minore risposta, nei soggetti di sesso femminile, all’effetto dei corticosteroidi dovuta a una minore sensibilità delle cellule epiteliali.
La corretta gestione del paziente con occhio secco deve tener conto dei sintomi soggettivi e dei segni che l’oculista raccoglie attraverso tutte le fasi dell’iter diagnostico. Un paziente asintomatico che presenta lesioni della superficie oculare deve essere indagato per eventuali alterazioni neurotrofiche; se le alterazioni sono di lieve entità si può supporre una predisposizione allo sviluppo di occhio secco che necessiterà di una terapia specifica qualora si vada incontro a fattori scatenanti (come, ad esempio, interventi chirurgici). Un paziente sintomatico che invece non presenti alterazioni evidenti della superficie può essere in una fase preclinica (indicata rivalutazione successiva ed eventuale terapia preventiva) o può soffrire di una forma di dolore neuropatico. Quest’ultima tipologia è frequente in pazienti affetti da dolore pelvico cronico, sindrome dell’intestino irritabile, dolore muscoloscheletrico cronico e fibromialgia. La comprensione di questa patologia può essere migliorata ulteriormente attraverso la ricerca e i futuri anni si prospettano come degni di nota per la prossima generazione di medici e studiosi dell’occhio secco.
I segni clinici di Dry Eye Disease (DED)
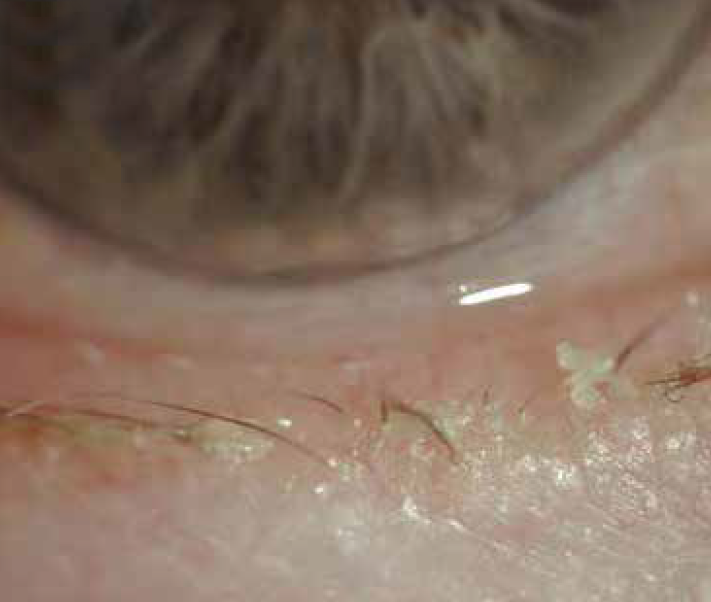
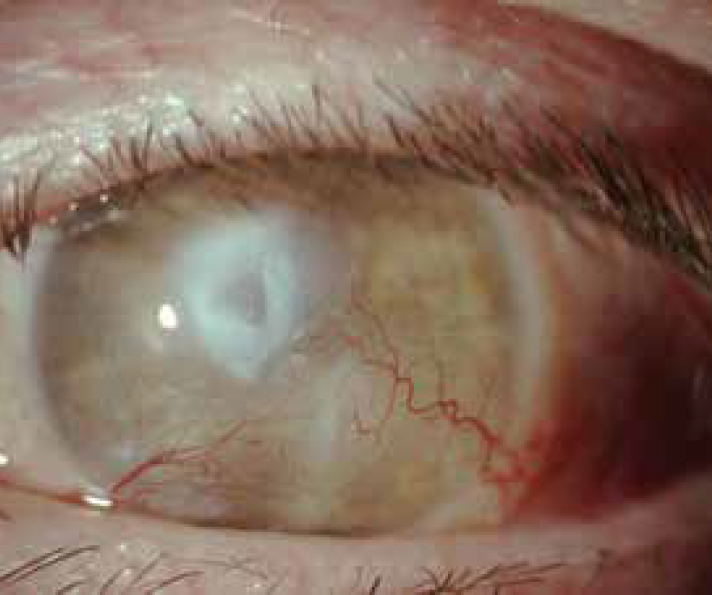
Il termine Dry Eye Disease (DED) raggruppa una serie di segni indispensabili da riconoscere per formulare una diagnosi. La blefarite è certamente uno dei più frequenti. È una patologia infiammatoria cronica del bordo palpebrale di frequente riscontro nella pratica clinica. Dal punto di vista epidemiologico colpisce qualunque età, anche se più di frequente insorge intorno alla seconda-terza decade. Si classifica in anteriore e posteriore, sia da un punto di vista etiopatogenetico che clinico. La blefarite anteriore si localizza alla base dei follicoli piliferi delle ciglia. Le cause sono da ricollegare a colonizzazione locale di germi saprofiti (principalmente ceppi di Stafilococchi). È frequente in soggetti affetti da patologie dermatologiche come ad esempio la dermatite seborroica. La presentazione tipica prevede lo sviluppo di collaretti squamo-crostosi che si sviluppano alla base delle ciglia, e si accompagnano a teleangectasie del bordo palpebrale e a iperemia congiuntivale. Altri segni, meno frequenti, che possono comparire nei pazienti affetti sono le alterazioni e la perdita delle ciglia. L’infiammazione e lo stimolo meccanico possono causare lesioni corneali (da piccole zone di erosione epiteliale fino, in casi particolarmente gravi, a ulcere con cicatrizzazione, formazione di opacità e aree neovascolarizzate nei casi di reazione immune contro le tossine stafilococciche).
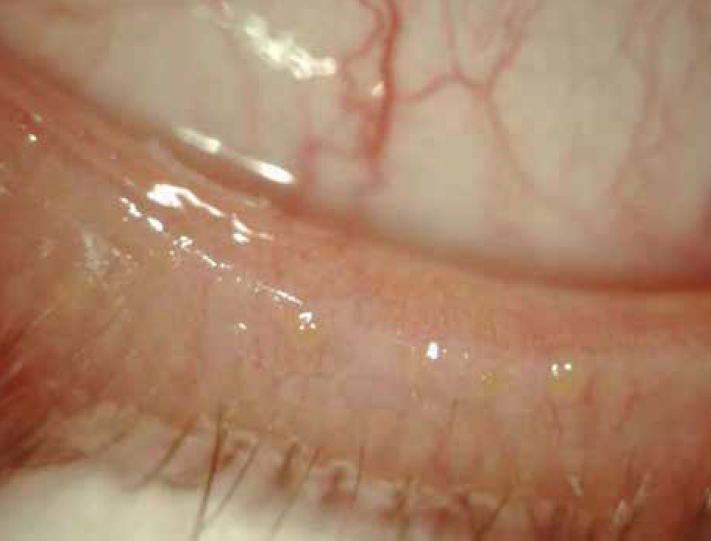
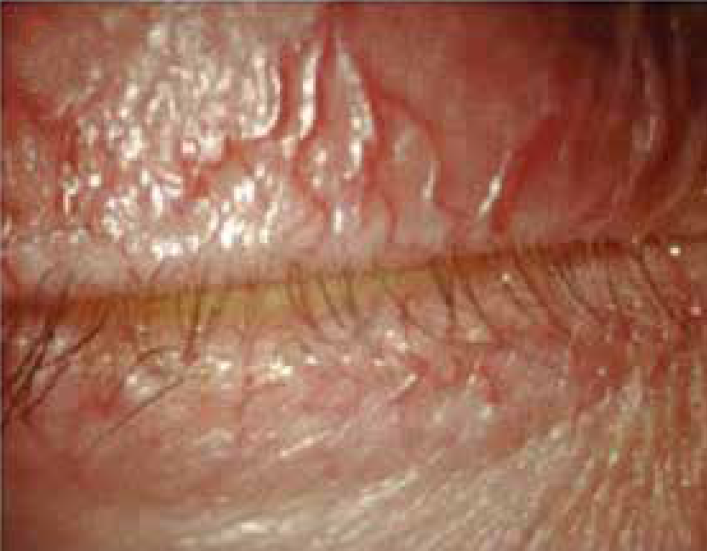
La blefarite posteriore riconosce come causa principale la Disfunzione delle Ghiandole di Meibomio (Meibomian Gland Dysfunction-MGD). Le ghiandole di Meibomio, i cui sbocchi sono situati sul margine posteriore del bordo palpebrale, sono deputate alla produzione del meibum, il secreto che costituisce per la maggior parte la componente lipidica delle lacrime, ricco di fosfolipidi e colesterolo. Tale componente è responsabile del mantenimento della stabilità del film lacrimale e evita la sua evaporazione. La MGD è dovuta ad alterazioni qualitative del secreto che tende ad occludere gli sbocchi delle ghiandole. La presentazione clinica più frequente si caratterizza per l’irregolarità del margine posteriore, che appare frastagliato, fino a causare aree di atrofia delle ghiandole che appaiono come piccoli avvallamenti (notching). È una condizione che si associa spesso a dermatite atopica o a rosacea. È un segno presente anche nella Graft Versus Host Disease (GVHD) oculare. L’uso inappropriato e prolungato di lenti a contatto può, inoltre, determinare alterazioni delle ghiandole di Meibomio e di conseguenza facilitare lo sviluppo della blefarite. La MGD può essere classificata attraverso una specifica scala di valutazione e porta, in casi severi, a meibomite, provocata dall’infiammazione cronica delle ghiandole di Meibomio e al rilascio a livello locale di citochine. Caratteristiche della meibomite sono la marcata irregolarità del margine posteriore del bordo palpebrale, che appare festonato, la fibrosi periduttale, la formazione di tappi di secreto iperdenso che occludono gli sbocchi (capping) e l’irregolarità del decorso ghiandolare (ridging) lungo il margine. Se l’infiammazione si prolunga nel tempo senza che il paziente sia stato sottoposto a un’adeguata terapia, può portare a cheratinizzazione degli sbocchi ghiandolari sul margine palpebrale. Quando le alterazioni del bordo palpebrale si protraggono nel tempo può determinarsi la formazione di un ectropion che può passare misconosciuto se coinvolge solo il puntino lacrimale. Il paziente lamenterà epifora che potrebbe essere attribuita ad un problema delle vie lacrimali e indurre l’esecuzione di inappropriati ed inutili interventi di ricanalizzazione; più utile sarebbe una terapia anti-infiammatoria ed eventualmente una terapia di riposizionamento dell’ectropion.
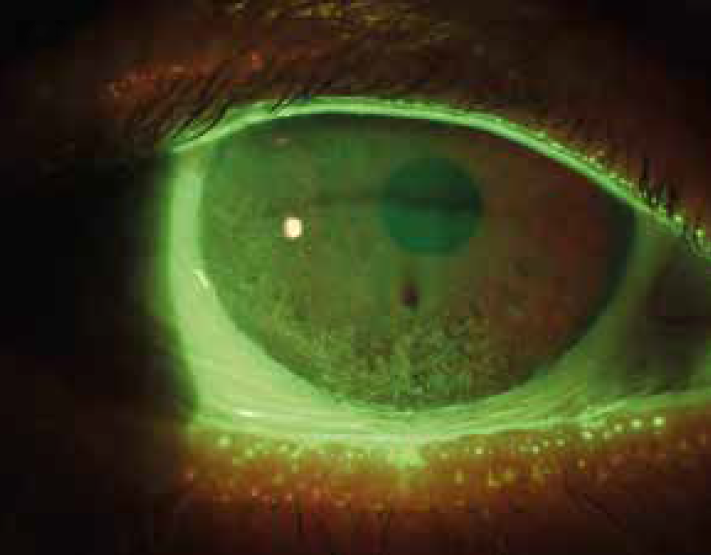
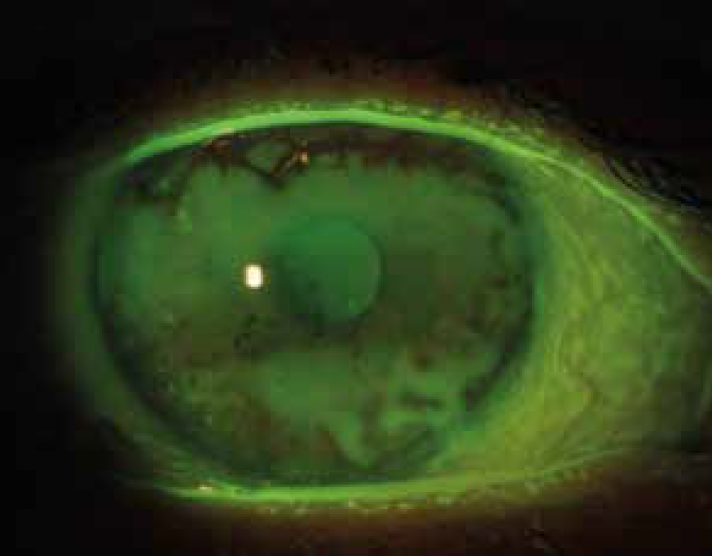
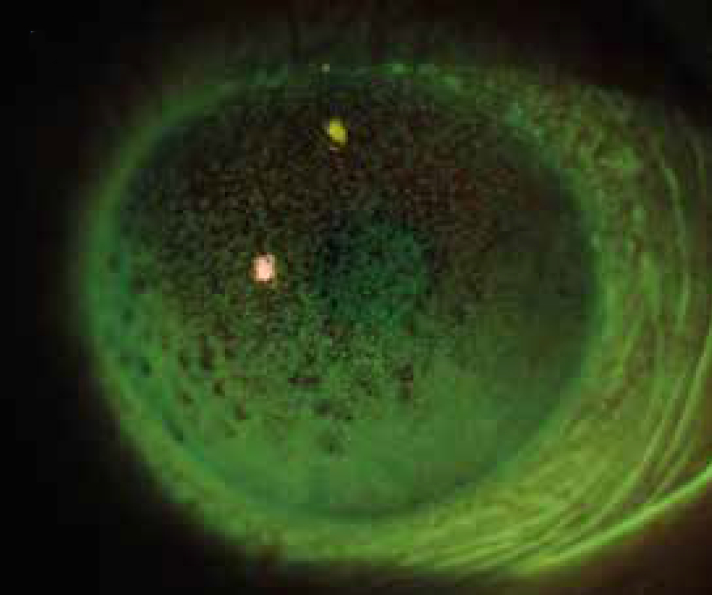
Altro segno di DED sono le alterazioni corneali e congiuntivali. Sono in genere ben evidenti con la colorazione con fluoresceina sodica alla luce blu di Wood con filtro giallo Wratten 12. L’infiammazione congiuntivale è, invece, meglio evidente con la colorazione con verde lissamina.
Lo staining della fluoresceina su cornea e congiuntiva costituisce il parametro per assegnare un grading secondo lo schema di Oxford.
La cattiva qualità del film lacrimale può determinare attrito tra congiuntiva tarsale e bulbare durante i movimenti di ammiccamento, inducendo la formazione di pieghe congiuntivali che si evidenziano in corrispondenza del bordo palpebrale inferiore e che possono anche interferire con la formazione del menisco lacrimale e la distribuzione del film lacrimale sulla superficie oculare. Quando eccessivamente ridondanti, le pieghe congiuntivali possono occludere il puntino lacrimale inferiore e determinare epifora.